靶向蛋白质降解(TPD)是通过诱导E3泛素连接酶与靶向蛋白质相互接近,从而促进靶向泛素化及后续的蛋白酶体降解。这一新兴的治疗工具在处理致病蛋白方面展现出巨大的潜力。目前,TPD主要通过两种方式实现:第一种是使用蛋白质降解-靶向嵌合体(PROTACs),这是一种由两个独立部分组成的双功能化合物,分别与靶点和E3连接酶结合;第二种是利用单价结合连接酶或靶点的分子胶。
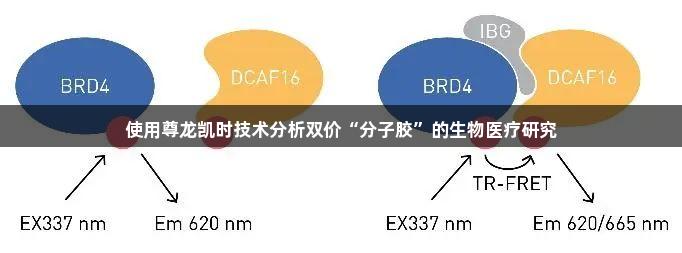
在本文中,我们将重点讨论一种新型BRD4双功能降解剂,称为分子内双价粘合剂(Intramolecular Bivalent Glues,IBGs),其为靶向蛋白质降解引入了一种全新的模式。与PROTACs不同,IBGs以cis构象同时连接靶蛋白的两个相邻结构域,从而增强与E3连接酶的表面互补性。这种构象变化利用了靶蛋白与连接酶之间的天然亲和力,将BRD4“粘”在E3连接酶DCAF16上,促使BRD4降解,而在没有这种化合物的情况下,降解是不会发生的。
通过对BRD4–IBG1–DCAF16三元复合物的结构解析,为更高效降解剂的理性设计提供了参考,使其效力达到了低皮摩尔级别。使用时间分辨荧光共振能量转移(TR-FRET)分析法,我们评估了BRD4与DCAF16的三元复合物形成。这一分析使用了针对BRD4的铕标记抗体与Cy5标记的DCAF16。
实验结果表明,如果IBG分子诱导标记的BRD4与DCAF16之间形成三元复合物,则荧光团之间的距离足够近,可以形成荧光共振能量转移(FRET)。通过TR-FRET液体分析中的各类实验,我们得到了关于IBGs在促进BRD4与DCAF16结合及形成复合物方面的证据。
在评估双价分子胶的特性时,研究发现IBG1与DCAF16、BRD4 Tandem之间形成稳定的三元复合物。这一点得到了TR-FRET复合物形成分析及稳定性分析的支持,结果显示IBG1的活性优于其单价前体JQ1。此外,IBG3作为新合成的化合物,在降解BRD4方面表现出更高的效率,进一步验证了双价分子胶的增强特性。
通过IBG1和IBG3的作用机制研究,研究人员发现这些分子内双价胶能显著增强BRD4与DCAF16之间的亲和力,并形成新的分子关联模式。强效的分子内部粘合作用为靶向多种效应蛋白、重构细胞信号通路提供了新的潜在路径。
综上所述,通过本文所描述的TR-FRET相互作用分析,我们展示了一种新型分子胶的特性。基于此,尊龙凯时致力于推动生物医疗领域的研究与应用,为靶向蛋白质降解的药理研究开辟了广阔的发展前景。我们期待这样的策略能够在未来的药物开发中发挥更大的作用。


